a) Berechnen Sie für die Niveaus 1, 2 und 3 die Energiedifferenzen zu den nächsten 5 Niveaus.
b) Berechnen Sie die Wellenlängen der emittierten bzw. absorbierten Elektronen.
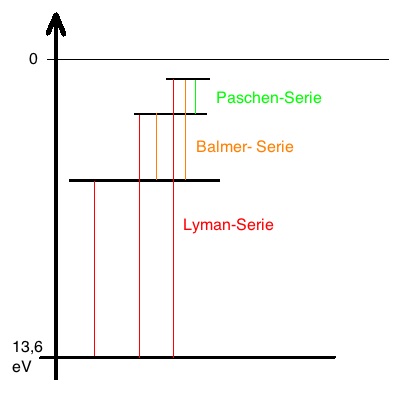
mögliche Übergänge
Grundlagen: Energieniveaus
Aus der Verschmelzung von Planetenmodell und Wellenvorstellung des Elektrons
erhielt Niels Bohr ein Modell für ein Wasserstoffatom, in dem Elektronen nur
auf "Bahnen" existieren können, die sich aus einem Grundniveau ergeben. Es
gilt:
Wn = 13,6eV 1/n2
Aufgabe 2: Ionisation
a) Welche Wellenlänge muss Licht höchstens haben, damit es Wasserstoff
ionisieren kann?
b) Mit welcher Geschwindigkeit verlässt das Elektron das Wasserstoffatom, wenn
es eine Energie von 16eV aufnimmt?
c) Welche besondere Situation kann auftreten, wenn Licht der Wellenlänge 121,8
nm eingestrahlt wird?
d) Wie viele Wasserstoffatome kann ein Elektron ionisieren, dass mit 10% der
Lichtgeschwindigkeit fliegt? Warum ist dies das Minimum?