Aggregatzustände
In welchen Formen liegen Stoffe vor?
Ein Material kann grundsätzlich in drei verschiedenen
Zuständen vorkommen, nämlich als Gas, als Flüssigkeit und als fester Stoff.
Diese drei Zustände nennt man Aggregatzustände. Man kann sie folgendermaßen
unterscheiden:
|
Eigenschaften |
Erklärung im Teilchenmodell |
Modellbild |
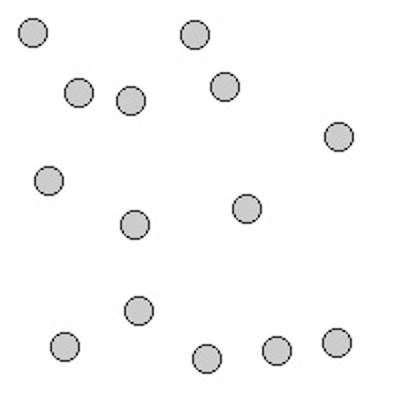
| gasförmig |
Die Form und das Volumen sind leicht veränderbar.
Beispiel: Luft
|
Die Teilchen haben keine Verbindung miteinander. D.h.
sie können sich frei gegeneinander Bewegen und auch ihren Abstand
beliebig ändern.
Ein anschauliches Modell sind kleine Holzkugeln, die in einem Gefäß
durch eine vibrierende Scheibe angestoßen werden und dadurch frei
umherfliegen.
|
 |
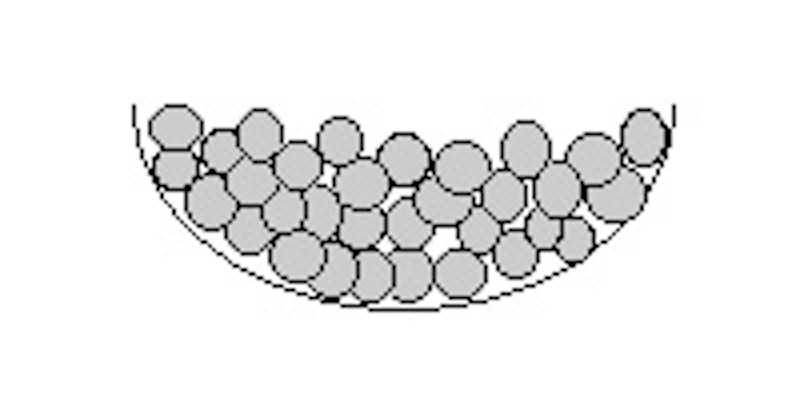
| flüssig |
Die Form ist leicht veränderbar, das Volumen aber
kaum.
Beispiel: (flüssiges) Wasser
|
Die Teilchen sind zwar miteinander verbunden, sie
bleiben aber beweglich, d.h. sie haben zwar einen festen Abstand
zueinander, können sich aber leicht gegeneinander verschieben.
Ein anschauliches Modell sind kleine Holzkugeln, die in einem Gefäß
liegen und gegeneinander verschoben werden können.
|
 |
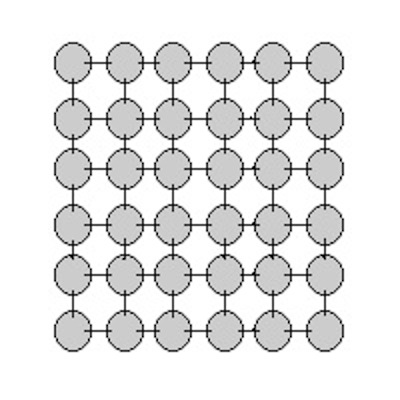
| fest |
Weder Form noch Volumen sind leicht veränderbar.
Beispiel: Stein
|
Die Teilchen haben eine starre Verbindung aufgebaut,
die sich weder im Abstand noch in der Position leicht verändern lässt.
Ein anschauliches Modell sind kleine Holzkugeln, die durch kleine
Stäbe miteinander verbunden sind.
|
 |
Viele Stoffe können in der Natur in verschiedenen
Aggregatzuständen vorkommen. Welchen Zustand sie einnehmen, hängt vom Druck und
von der Temperatur ab. Wasser kann je nach Temperatur als flüssiges Wasser,
Wasserdampf und Eis vorliegen, Stein kann auch als flüssiges Magma
vorkommen.
Daher ist es auch möglich, dass ein Stoff seinen Aggregatzustand ändert. Z.B.
schmilzt Eis, wenn seine Temperatur höher als 0°C wird.
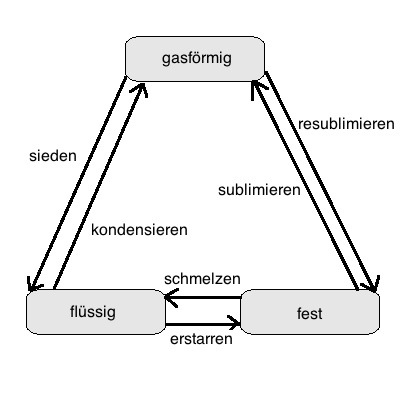
Diese Übergänge haben folgende Bezeichnungen:
| von ... nach ↱ |
gasförmig |
flüssig |
fest |
| gasförmig |
|
kondensieren:
Dies geschieht bei Abkühlung unter den Siedepunkt oder
durch starken Anstieg des Druckes.
Die Gasteilchen kühlen soweit ab, dass sie sich aneinanderlegen und
sich verbinden..
Beispiel: Wasser am Topfdeckel
|
resublimieren:
Dies geschieht bei Abkühlung unter den
Sublimationspunkt.
Die Gasteilchen bauen schlagartig eine starke Bindung auf und können
sich nun nicht mehr frei bewegen.
Beispiel: Herstellung von Trockeneis (gefrorenem CO2)
|
| flüssig |
sieden:
Dies geschieht bei Erwärmung über den Siedepunkt oder
durch starken Abfall des Druckes.
Die Flüssigkeitsteilchen verlieren aufgrund der Wärmebewegung ihre
Bindung und können sich nun frei bewegen.
Beispiel: Wasser im Kochtopf bei 100°C
|
|
erstarren:
Dies geschieht bei Abkühlung unter den Schmelzpunkt.
Die Flüssigkeitsteilchen verstärken ihre Bindung so sehr, dass sie
sich nicht mehr gegeneinander verschieben können.
Beispiel: Wasser im Gefrierfach
|
| fest |
sublimieren:
Dies geschieht bei Erwärmung über den
Sublimationspunkt.
Die Teilchen verlieren schlagartig ihre gesamte Bindung und können
sich nun frei bewegen.
Beispiel: Trockeneis (gefrorenes CO2)
|
schmelzen:
Dies geschieht bei Erwärmung über den Schmelzpunkt.
Die Teilchen verlieren einen Teil ihrer Bindung, so dass sie sich
gegeneinander verschieben können.
Beispiel: Eiswürfel im Getränk
|
|
Das folgende Bild fasst diese Tabelle noch einmal zusammen:
zurück
home
inhalt



