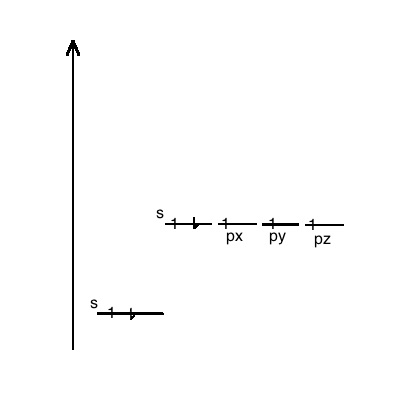
Der erste Energiezustand (n=1) enthält 2 Elektronen im s-Orbital.
Der zweite Energiezustand (n=2) enthält die verbleibenden 5 Elektronen. Davon befinden sich 2 im s-Orbital und die restlichen 3 in den p-Orbitalen.
Aufgabe 1: Quantenzahlen
a)
Für n=1 sind nur 2 Zustände möglich: aus n=1 folgt l=0 (s-Orbital) mit m=0
(nicht magnetisch). s kann die Werte +1/2 und -1/2 annehmen.
Für n=1 sind 8 Zustände möglich:
c) Zu den 8 Zuständen für l=0 und l=1 (s.o.) müssten noch
weitere 10 für l=2 hinzukommen:
Aus l=2 folgt: m = -2,..., 2. Außerdem gilt jeweils s=±1/2
Diese 10 Zustände tauchen aber erst in der 4. Periode auf.
Dies lässt sich nur dadurch erklären, dass der d-Zustand in der 3. Periode
energetisch unter dem p-Zustand der 4. Periode liegt.
Gäbe es diese Ausnahme nicht, so gäbe es bereits in der 3. Periode Elemente mit
bis zu 18 Außenelektronen, was erhebliche Auswirkungen auf unsere Chemie und
Physik hätte.
| d) |
|
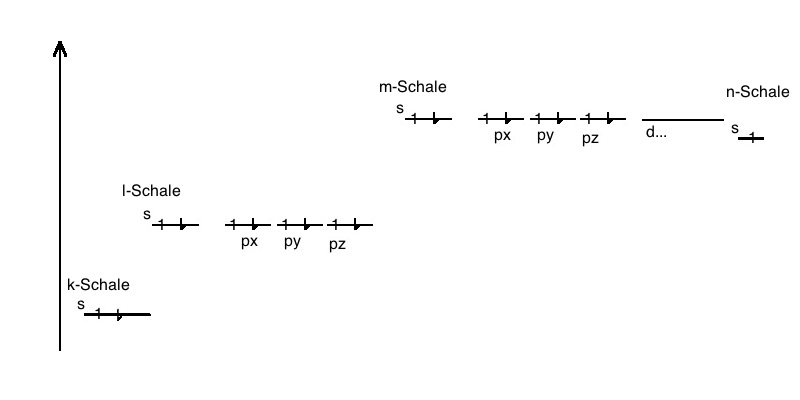
e) Die ab der 3. Periode möglichen d-Formen werden erst ab der
4. Periode aufgefüllt, sobald die ersten zwei Elektronen das s-Orbital besetzt
haben. Entsprechend wird das ab der 4. Periode mögliche f-Orbital erst ab der
6. Periode aufgefüllt.
Diese zwei "verzögert" aufgefüllten Orbitale befinden sich weiter innen im
Atom. D.h. Jedes dieser Atome enthält in seinem Inneren Schalen, die nicht
vollständig gefüllt sind. Es ist besonders leicht, aus diesen Schalen
Elektronen herauszulösen und weiterzubewegen. Daher können alle diese Stoffe
gut den Strom leiten und sind daher Metalle.