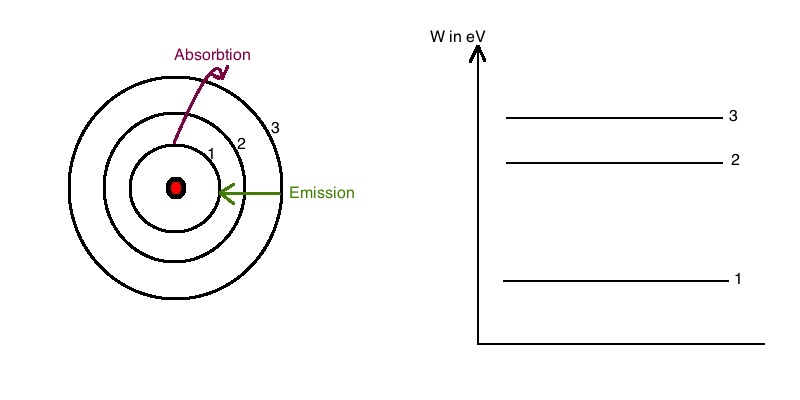
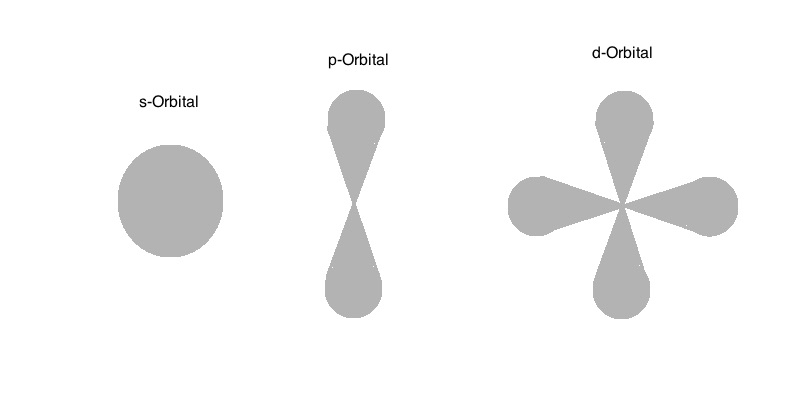
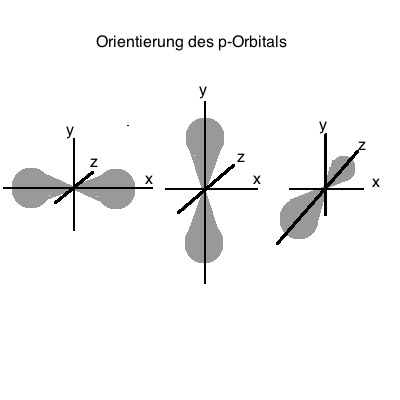
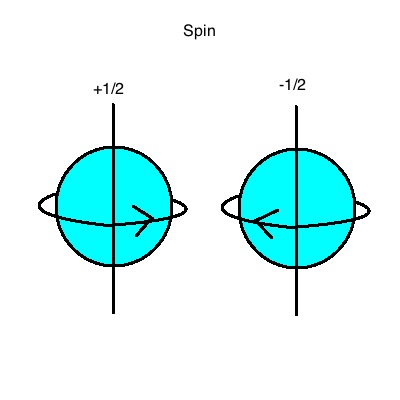
Innerhalb eines Atoms können die Elektronen nur bestimmte Energiezustände einnehmen. Sie können zwischen diesen Energiezuständen wechseln, wenn sie Energie aufnehmen (Absorbtion) oder abgeben (Emission).
Dem Energieniveau wird eine natürliche Zahl n zugeordnet, die Hauptquantenzahl genannt wird. Die Schalen werden mit den Buchstaben k, l, m, ... bezeichnet.
| Quantenzahl n | Schalenbezeichnung |
| 1 | k |
| 2 | l |
| 3 | m |
| 4 | n |
| ... | ... |