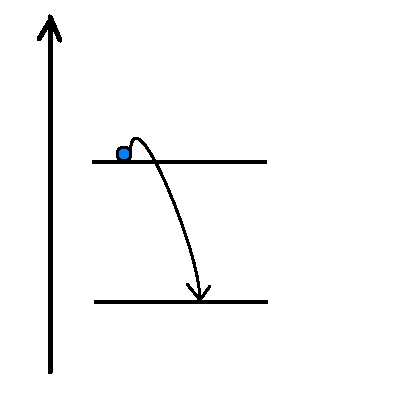
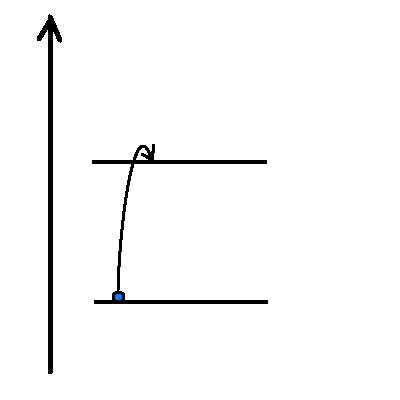
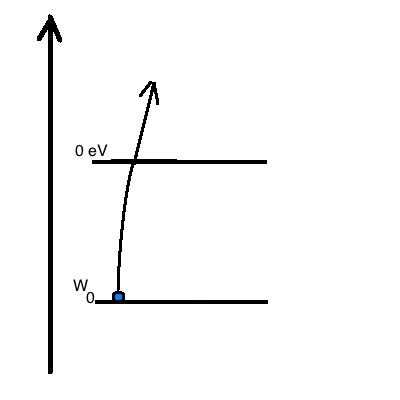
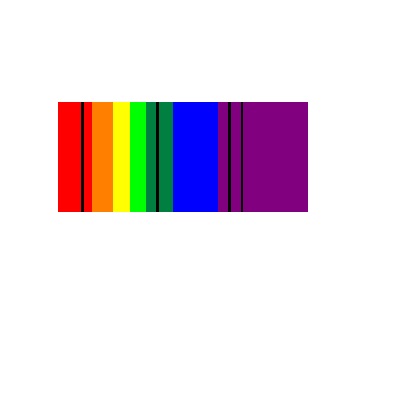Wenn ein kontinuierliches Lichtspektrum durch ein Gas geleitet wird, absorbieren die Atome oder Moleküle bestimmte Wellenlängen des Lichts, die den Energiedifferenzen zwischen den Elektronenzuständen im Gas entsprechen. Nach der Absorption wird das Licht mit denselben Wellenlängen wieder emittiert, jedoch isotrop in alle Richtungen, sodass nur ein Bruchteil in die ursprüngliche Richtung weitergeleitet wird.
Mathematische Herleitung
Die Intensität des Lichts nach der Absorption folgt dem Lambert-Beer-Gesetz:
wobei
Die emittierte Intensität ist proportional zur Anzahl der angeregten Atome:
Da die Emission isotrop erfolgt, gelangt nur ein Teil davon in die ursprüngliche Richtung. Die beobachtete Intensität ergibt sich als:
Hierbei ist