Isotope
gleiches Element - unterschiedliche Masse
Grundlagen: Varianten im Kernaufbau
Ein Element ist durch seine chemischen Eigenschaften, insbesondere also durch
seine Elektronenhülle gekennzeichnet. Da die Elektronenanzahl mit der Anzahl
der Protonen im Kern identisch ist, gibt es in der Regel für jedes Elemnt auch
einen spezifischen Atomkern. Für kleine Atomkerne bis hin zu Sauerstoff
gilt, dass die Anzahl der Neutronen im Kern gleich der Anzahl der
Protonen ist, die Massenzahl ist also doppelt so hoch wie die Kernladungszahl.
Für größere Kerne gilt, dass die Neuronenanzahl höher sein muss als die
Protonenanzahl, da die Neutronen die sich gegenseitig abstoßenden Protonen
gewissermaßen "zusammenkleben".
Alle Atome scheinen also eine vorgegebene Elektronenhülle und einen
vorgegebenen Kern zu haben.
Dies gilt aber nur auf den ersten Blick. Tatsächlich ist es möglich, dass der
Kern nicht die übliche Anzahl an Neutronen enthält, sondern dass ihre Zahl
insbesondere bei den großen Atomen um mehr als 10 vom üblichen Wert abweicht.
Vom Eement Thorieum (Kernladungszahl 90) kennt man z.B. 24 verschiedene
Varianten, die Massenzahl schwankt von 213 bis 236. Diese Varianten nennt man
Isotope.
Die meißten dieser Isotope sind radioaktiv, d.h. sie zerfallen schnell in andere - i.d.R. stabilere
Varianten.
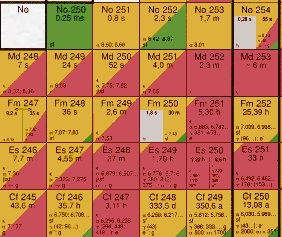
Nuklidkarte Alle Informationen zu Hülle und Kern in
einer Karte
In einer Nuklidkarte werden auch die verschiedenen Kernvarianten
berücksichtigt. Für jedes Element werden - in der Regel zeilenweise -
alle Kernvarianten aufgezählt. Zusätzlich werden ihre Haufigkeit, die
Zerfallsart und die damit verbundene Halbwertzeit angegeben. |
|
zurück
home
inhalt
