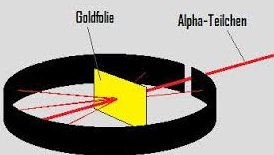
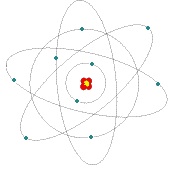
Diese Theorie taucht am ausgeprägtesten erstmals bei Empedokles, einem giechischen Philosophen im 5. Jh. v. Chr. auf. Alle Materie besteht aus den 4 Grundelementen, die gleichzeitig auch die Eigenschaften der Materie bestimmen. Genau genommen wird nicht wirklich zwischen dem Bestandteil und der Eigenschaft unterschieden.